Le politiche sui dispositivi medici
🎧 Ascolta il podcast dell’articolo
🧑🎓Seguici su Youtube alla playlist Verso una nuova cardiologia
📘 Panorama internazionale, europeo e sulle politiche sui dispositivi medici
La guida offre un panorama internazionale, europeo e italiano sui dispositivi medici che ormai rappresentano uno degli elementi fondamentali dei sistemi sanitari moderni.
La regolamentazione dei dispositivi medici richiede un quadro normativo articolato che garantisca sicurezza, efficacia e accesso equo. L'articolo analizza le politiche sui dispositivi medici a tre livelli:
- le linee guida dell'Organizzazione Mondiale della Sanità (OMS),
- il Regolamento Europeo MDR
- le disposizioni nazionali del Ministero della Salute italiano.
Le politiche OMS sui dispositivi medici
Il framework globale OMS
L'OMS (WHO) ha sviluppato un framework normativo completo per la regolamentazione dei dispositivi medici: Il documento "Development of medical devices policies" (seconda edizione, 2025) costituisce la pietra miliare delle politiche globali.
Tale framework si basa su tre dimensioni fondamentali per raggiungere la copertura sanitaria universale:
- la prima riguarda la popolazione coperta.
- la seconda si concentra sui servizi sanitari disponibili.
- la terza affronta i costi diretti sostenuti dai pazienti.
Gli obiettivi di sviluppo sostenibile 2030
Le politiche WHO sui dispositivi medici si integrano con gli Obiettivi di Sviluppo Sostenibile delle Nazioni Unite. L'obiettivo 3 punta a garantire salute e benessere per tutti. Gli obiettivi secondari includono la riduzione della mortalità materna e infantile. Inoltre, si mira a raggiungere la copertura sanitaria universale entro il 2030.
Le politiche OMS: di seguito una guida completa per l'equità e la prevenzione della salute
Politiche OMS: guida a equità e prevenzione →
Il rapporto OMS sui dispositivi medici spiega come politiche, equità e governance tecnologica rafforzano i sistemi sanitari e riducono il...
Il Medical Device Regulation (MDR)
Il Regolamento (UE) 2017/745
Il Regolamento (UE) 2017/745, noto come Medical Device Regulation (MDR), ha rivoluzionato il settore europeo. È entrato in vigore il 25 maggio 2017. La sua piena applicazione è avvenuta dal 26 maggio 2021. Il regolamento ha sostituito le precedenti direttive 93/42/CEE e 90/385/CEE.
Gli Obiettivi del Regolamento MDR
Il MDR mira a garantire un elevato livello di sicurezza e protezione della salute. Inoltre, promuove l'innovazione nel settore dei dispositivi medici. Il regolamento stabilisce un quadro normativo robusto e trasparente. Facilita il funzionamento del mercato interno dell'Unione Europea.
Unione Europea e le politiche sui dispositivi medici →
L'Unione Europea sta rivoluzionando il settore dei dispositivi medici con una strategia integrata: dai nuovi regolamenti MDR e IVDR alla...
Le politiche italiane del Ministero della Salute
Il quadro normativo nazionale
In Italia, il settore dei dispositivi medici è regolamentato dal Ministero della Salute. La normativa nazionale si coordina con i regolamenti europei. I Decreti legislativi n. 507/92 e n. 46/97 sono stati abrogati con l'entrata in vigore del MDR.
La direzione generale dei dispositivi medici e del farmaco
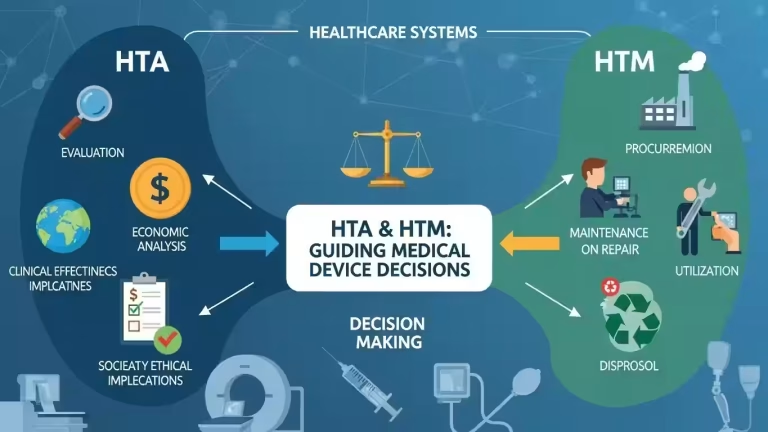
La Direzione Generale svolge funzioni cruciali per il settore. Completa e attua la disciplina dei dispositivi medici. Si occupa della sorveglianza del mercato nazionale. Autorizza gli Organismi Notificati operanti in Italia. Gestisce la vigilanza sugli incidenti e le indagini cliniche.
Inoltre, valuta le tecnologie sanitarie attraverso l'Health Technology Assessment. Monitora i consumi dei dispositivi medici acquistati dal Servizio Sanitario Nazionale.
Italia e le politiche sui dispositivi medici →
Il Ministero della Salute italiano sta implementando politiche innovative sui dispositivi medici in linea con le raccomandazioni OMS: dal Registro...
Il coordinamento tra WHO, UE e Italia
Le politiche nazionali italiane si allineano al framework europeo. Il MDR recepisce molti principi delle linee guida WHO. L'Italia partecipa attivamente ai gruppi di lavoro europei e internazionali. Questo coordinamento garantisce coerenza e armonizzazione normativa.
Le prospettive future
L'intelligenza artificiale rappresenta una frontiera emergente. I regolatori stanno sviluppando framework specifici per i dispositivi AI-based. La telemedicina e i dispositivi indossabili richiedono approcci normativi innovativi. La sostenibilità ambientale diventerà sempre più centrale nelle politiche.
📌Conclusione
Le politiche sui dispositivi medici richiedono un approccio multilivello coordinato. Le linee guida WHO forniscono un framework globale completo. Il Regolamento europeo MDR stabilisce standard elevati per il mercato europeo. Le disposizioni italiane del Ministero della Salute assicurano l'implementazione nazionale efficace.
La convergenza tra questi tre livelli garantisce sicurezza, qualità e accesso ai dispositivi medici. L'armonizzazione normativa facilita il commercio internazionale. Il coordinamento tra autorità migliora la sorveglianza e la vigilanza. L'obiettivo finale è proteggere la salute dei pazienti promuovendo l'innovazione sostenibile.