Nomenclatura e regolamentazione dei dispositivi medici
Nomenclatura e sistemi standardizzati per la salute globale
La nomenclatura dei dispositivi medici rappresenta un elemento fondamentale per l'organizzazione e la gestione dei sistemi sanitari. Consiste in codici e nomi standardizzati per classificare e identificare i dispositivi medici e i relativi prodotti sanitari.
L'importanza della standardizzazione
L'uso di diversi sistemi di nomenclatura può complicare gli scambi di informazioni essenziali tra individui e organizzazioni. Può avere conseguenze negative sulla salute, sull'economia e sulla società. Un sistema di classificazione e denominazione standardizzato per i dispositivi medici fornisce un linguaggio comune.
Questo linguaggio è fondamentale per documentare e segnalare i dispositivi in tutto il sistema sanitario. Funziona a tutti i livelli di assistenza e per tutti gli scopi. L'OMS supporta l'adozione di un sistema di nomenclatura accessibile globalmente, trasparente e armonizzato. Questo include termini, codici e definizioni.
La nomenclatura potrebbe essere inclusa nella politica nazionale sui dispositivi medici. L'obiettivo è armonizzarne l'uso localmente, regionalmente e nazionalmente. Serve per la regolamentazione, la valutazione, l'approvvigionamento, la gestione e la reportistica. Come indicato nel framework regolatorio globale, i benefici si realizzano quando lo stesso sistema viene usato in modo coerente e accurato.
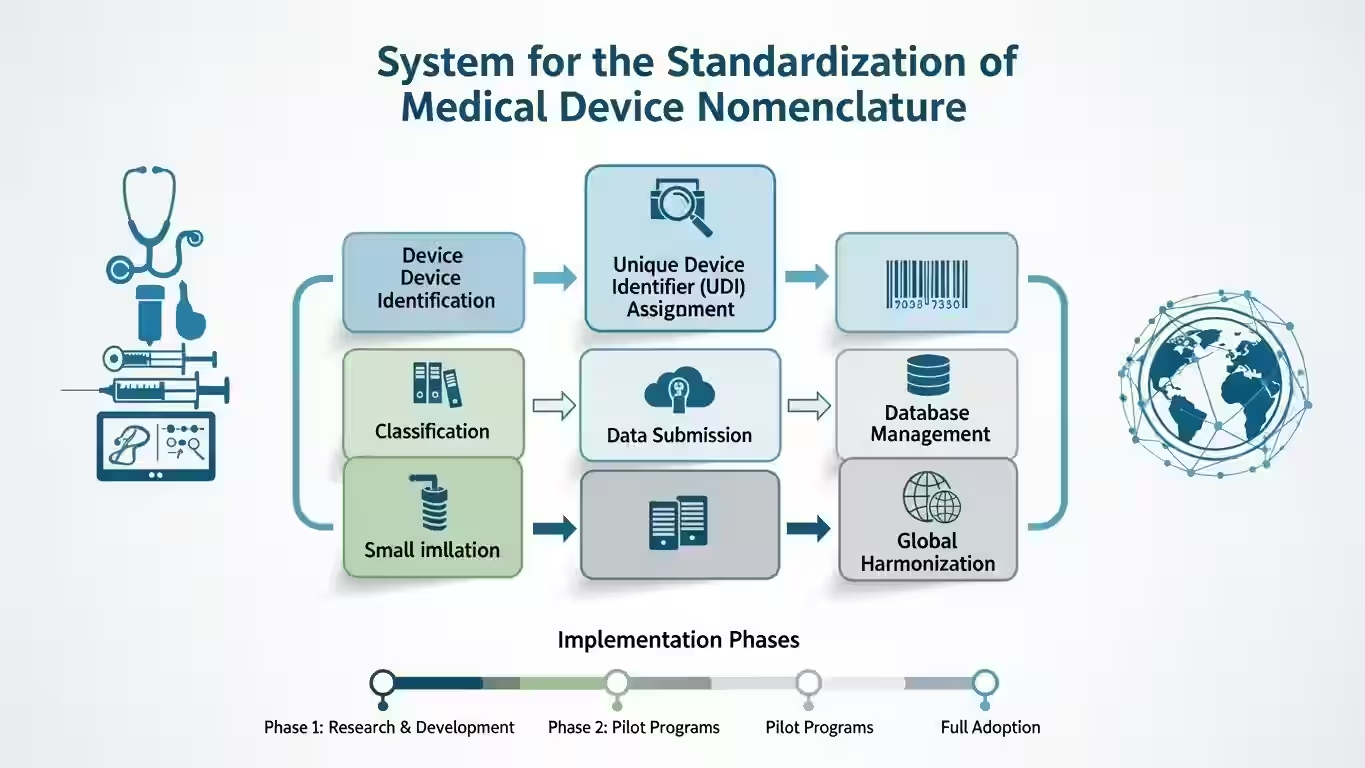
I sistemi di nomenclatura disponibili
Dal 2022, l'OMS ha adottato i codici e i termini della Nomenclatura Europea dei Dispositivi Medici (EMDN). Da marzo 2024, l'OMS è stata anche autorizzata a utilizzare la Nomenclatura Globale dei Dispositivi Medici (GMDN). Il sistema informativo dei dispositivi medici prioritari (MeDevIS) include ora entrambi i sistemi di nomenclatura.
L'OMS ha progressivamente esteso il loro uso ad altri database e pubblicazioni. L'OMS incoraggia gli Stati membri a utilizzare uno di questi sistemi di nomenclatura. Questo serve per promuovere l'armonizzazione ed evitare la creazione di altri sistemi. Altri sistemi complicherebbero l'identificazione corretta dei dispositivi medici a livello locale, regionale, nazionale e per il benchmarking internazionale.
I due approcci alla denominazione dei dispositivi medici sono i sistemi di nomenclatura. Sistemi come GMDN e il Sistema Universale di Nomenclatura dei Dispositivi Medici sono multi-gerarchici. I sistemi di classificazione come la Classificazione Nazionale dei Dispositivi Medici in Italia e l'EMDN sono gerarchici. Ogni approccio ha vantaggi e limitazioni.
La Nomenclatura Europea dei Dispositivi Medici (EMDN)
L'EMDN è utilizzata nel quadro normativo dell'Unione Europea per i dispositivi medici. È progettata per essere accessibile e trasparente. Il sistema è alfanumerico e include un albero gerarchico di sette livelli. I dispositivi medici sono classificati in tre livelli principali: categoria, gruppo e tipo, con un massimo di 13 cifre.
Maggiori informazioni sulla struttura dell'EMDN e il database completo sono disponibili sul sito web della Commissione Europea.
La Nomenclatura Globale dei Dispositivi Medici (GMDN)
La GMDN è un sistema riconosciuto internazionalmente per denominare e raggruppare i dispositivi medici. Fornisce termini standardizzati per l'uso nel commercio globale, nelle attività regolatorie e nella fornitura sanitaria. È utilizzata da autorità regolatorie, tra cui l'Amministrazione dei Beni Terapeutici in Australia e l'Agenzia di Regolamentazione dei Medicinali e dei Prodotti Sanitari nel Regno Unito.
Il database non è tuttavia completamente accessibile al pubblico. Un'istituzione o altro utente deve registrarsi presso l'agenzia GMDN per poterlo utilizzare.
L'identificazione univoca dei dispositivi
Il sistema di identificazione univoca dei dispositivi (UDI) fornisce un'identificazione standardizzata dei dispositivi medici. Migliora la sicurezza dei pazienti, la gestione della catena di fornitura e il tracciamento dei dispositivi. Consiste nell'assegnazione di un codice alfanumerico riconosciuto globalmente. Questo include un identificatore fisso del dispositivo e un identificatore variabile di produzione.
I dati sono archiviati in database pubblici nazionali. Le informazioni sulla struttura, la funzione e gli organismi emittenti di UDI sono disponibili. L'IMDRF ha creato un framework per le autorità regolatorie e i produttori. Devono sviluppare e implementare i loro sistemi UDI in modo armonizzato globalmente.
Per beneficiare pienamente di un sistema UDI, i gestori sanitari potrebbero utilizzare anche i dati nei database UDI associati. Questi includono il database europeo sui dispositivi medici UDI e il modulo di registrazione dei dispositivi del Global Unique Device Identification Database della FDA statunitense.
La ricerca e l'innovazione nei dispositivi medici
La ricerca e sviluppo in sanità è solitamente svolta in istituti di ricerca di alto livello. Questi includono istituti nazionali di sanità o settore accademico di università. Può essere nel settore privato, inclusa l'industria e startup innovative. È solitamente coordinata da un consiglio nazionale di scienza o ricerca.
Per affrontare efficacemente i bisogni nazionali, le strategie accademiche e di ricerca devono corrispondere alle priorità sanitarie della popolazione. Quando i ricercatori sviluppano tecnologie innovative, devono identificare correttamente la sfida sanitaria. Devono affrontarla per priorità e popolazione target.
L'OMS fornisce una panoramica delle tecnologie sanitarie innovative per contesti a basse risorse. Include un metodo validato per guidare la R&D. Il compendio delle tecnologie sanitarie innovative per contesti a basse risorse 2024 offre un framework robusto e validato. Serve per valutare l'appropriatezza delle tecnologie e cita tecnologie innovative valutate per efficacia clinica, conformità e fattibilità della produzione locale.
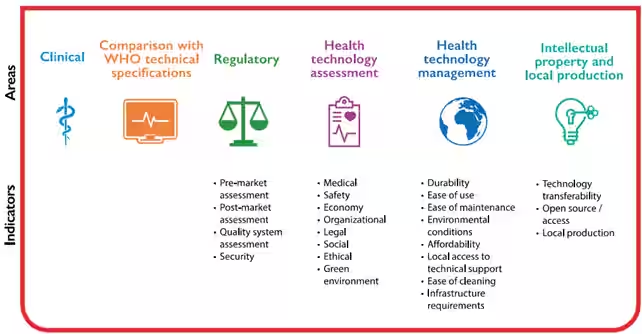
Il mercato globale e gli accordi commerciali
Nel 2022, il valore delle esportazioni di apparecchiature elettro-mediche e radiologiche era di 54,4 miliardi di dollari USA. Rappresentava lo 0,7% delle esportazioni globali di macchinari e attrezzature di trasporto. Il valore delle importazioni era di 56,0 miliardi di dollari USA.
Il Sistema Armonizzato è un sistema internazionale di classificazione dei prodotti. È sviluppato dall'Organizzazione Mondiale delle Dogane. Consiste in oltre 5000 gruppi di merci identificati da codici a sei cifre. Il sistema è utilizzato da oltre 100 paesi come base per tariffe doganali, statistiche commerciali e varie politiche economiche e commerciali.
La proprietà intellettuale incoraggia l'innovazione ma può limitare l'accesso a tecnologie sanitarie accessibili nei mercati a bassa domanda. Politiche flessibili, come quelle incluse nella Dichiarazione di Doha dell'Organizzazione Mondiale del Commercio, bilanciano innovazione con bisogni di salute pubblica. L'OMS, l'Organizzazione Mondiale del Commercio e l'Organizzazione Mondiale della Proprietà Intellettuale supportano i paesi nell'allineare la proprietà intellettuale con gli obiettivi sanitari.
📌Conclusione
La standardizzazione della nomenclatura e la regolamentazione efficace dei dispositivi medici sono elementi fondamentali per garantire sistemi sanitari sicuri ed efficienti. L'adozione di sistemi di nomenclatura riconosciuti internazionalmente come EMDN e GMDN facilita la comunicazione tra stakeholder e migliora la gestione dei dispositivi.
L'implementazione di sistemi UDI rappresenta un passo cruciale per la tracciabilità e la sicurezza. Permette una gestione migliore della catena di fornitura e protegge i pazienti. La ricerca e l'innovazione devono essere guidate dalle priorità di salute pubblica, garantendo che le nuove tecnologie rispondano ai bisogni reali delle popolazioni.
Il mercato globale dei dispositivi medici richiede un equilibrio tra protezione della proprietà intellettuale e accesso equo alle tecnologie sanitarie. Le politiche commerciali devono considerare le esigenze dei paesi a basse risorse. Solo attraverso un approccio coordinato e armonizzato a livello globale sarà possibile garantire che i dispositivi medici contribuiscano efficacemente al miglioramento della salute delle popolazioni in tutto il mondo.
👉 Questo articolo fa parte della guida Spels alle politiche OMS sui dispositivi medici. Consulta la pillar page per la visione d’insieme e gli altri approfondimenti.